Аннотация:
Рак толстой кишки (колоректальный рак, КРР) является основным, глобальным бременем мирового здравоохранения. Ежегодно в мире насчитывается более 1,3 млн новых случаев заболеваемости КРР и 700 тыс. случаев смерти от этого заболевания. В нашей стране КРР занимает третье место в структуре онкологической заболеваемости (30,0 на 100 тыс. населения) и смертности от онкологических заболеваний (19,9 на 100 тыс. населения) у мужчин и второе место в структуре онкологической заболеваемости (21,8 на 100 тыс. населения) и смертности от онкологических заболеваний (11,5 на 100 тыс. населения) у женщин.
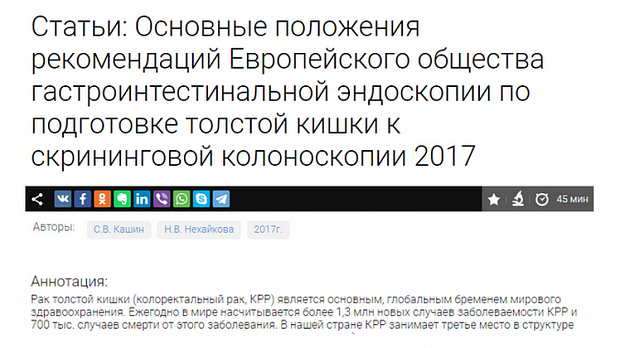
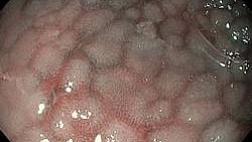
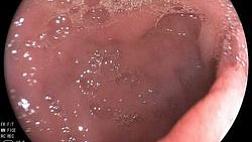
Не менее 95% случаев КРР развивается из существующих полиповидных или плоских аденом в толстой кишке. Поэтому прерывание последовательности аденома—аденокарцинома является профилактической мерой в отношении КРР.
Скрининг КРР осуществляет профилактику КРР по двум направлениям:
- обнаружение и удаление предраковых изменений, которые позднее могут подвергнуться малигнизации;
- обнаружение КРР на ранней стадии, который может быть эффективно пролечен, что является хорошим прогностическим критерием для полного выздоровления пациента.
Результаты ряда исследований показывают, что от 3 до 6% КРР диагностируются в промежутке между скрининговой колоноскопией и постскрининговой колоноскопией, проводимой в рамках эндоскопического наблюдения. Большинство этих случаев рака (интервальный рак) развилось из образований, пропущенных во время проведения скрининговой колоноскопии. В соответствии с проведенными исследованиями и представленными доказательствами эффективность колоноскопии зависит от качества осмотра слизистой оболочки толстой кишки. Высокое качество очистки толстой кишки является важной предпосылкой для улучшения качества колоноскопии, потому что даже небольшое количество остаточного кишечного содержимого может скрывать значительные по размеру новообразования толстой кишки. Показатель очистки толстой кишки перед колоноскопией является одним из семи ключевых показателей эффективности выполнения колоноскопии.
Для оценки уровня очистки толстой кишки используют различные валидированные шкалы. Наиболее часто применяют шкалы Оттава (Ottawa Bowel Preparation Scale) и Бостон (Boston Bowel Preparation Scale).
ESGE (European Society of Gastrointestinal Endoscopy) в 2013 г. представило рекомендации по подготовке толстой кишки к колоноскопии.
- ESGE рекомендует диету с низким содержанием клетчатки в день накануне колоноскопии.
- ESGE не дает никаких рекомендаций относительно использования диеты с низким содержанием клетчатки в течение более чем 24 ч до момента исследования.
- ESGE не рекомендует рутинное использование прокинетиков в качестве дополнения к подготовке кишечника к колоноскопии.
- ESGE предлагает добавлять симетикон к стандартной подготовке кишечника к колоноскопии.
- ESGE рекомендует двухэтапный режим приема (сплитрежим) 4 л раствора полиэтиленгликоля (ПЭГ) (или режим приема всей дозы слабительного препарата в день исследования в случае выполнения колоноскопии во второй половине дня) для рутинной подготовки толстой кишки.
- Двухэтапный режим приема (сплит-режим) 2 л ПЭГ в комбинации с аскорбатом или пикосульфатом натрия и цитратом магния (или режим приема всей дозы слабительного препарата в день исследования в случае выполнения колоноскопии во второй половине дня) может быть приемлемой альтернативой, особенно в случае амбулаторной колоноскопии.
- У пациентов с почечной недостаточностью ПЭГ является единственным рекомендованным препаратом для подготовки кишечника.
- Временной интервал между приемом последней дозы препарата для подготовки кишечника и колоноскопией должен быть минимизирован и составлять не более 4 ч.
- ESGE не рекомендует рутинное использование фосфата натрия для подготовки кишечника к колоноскопии из-за риска развития побочных эффектов.
- ESGE рекомендует, чтобы проведение письменного и устного информирования пациентов по подготовке кишечника к колоноскопии осуществлялось медицинскими работниками.
Стандарт: минимальный стандарт — не менее 90%; целевой стандарт — не менее 95% . Если минимальный стандарт (не менее 90%) не был достигнут, то необходимо провести анализ факторов, влияющих на подготовку толстой кишки на уровне эндоскопического отделения.
Список литературы:
1. 2017. Available at: Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 (Internet). Lyon, France: International Agency for Research on Cancer; 2013. Accessed September 2, 2017. http://globocan.iarc.fr, accessed on 13/January/2015 2. Altobelli E, D’Aloisio F, Angeletti P. Colorectal cancer screening in countries of European Council outside of the EU-28. World Journal of Gastroenterology. 2016;22(20):4946. https://doi.org/10.3748/wjg.v22.i20.4946 3. Chen C, Yen M, Wang W, Wong J, Chen T. A case—cohort study for the disease natural history of adenoma—carcinoma and de novo carcinoma and surveillance of colon and rectum after polypectomy: implication for efficacy of colonoscopy. British Journal of Cancer. 2003;88(12):1866-1873. https://doi.org/10.1038/sj.bjc.6601007 4. Selby J, Friedman G, Quesenberry C, Weiss N. A Case—Control Study of Screening Sigmoidoscopy and Mortality from Colorectal Cancer. New England Journal of Medicine. 1992;326(10):653-657. https://doi.org/10.1056/nejm199203053261001 5. Danese S, Laghi L, Repici A, Malesci A. Colorectal cancer screening: Dying en route?. Digestive and Liver Disease. 2010;42(5):350-351. https://doi.org/10.1016/j.dld.2010.03.001 6. 2017. Available at: WHO cancer country profile. Accessed September 2, 2017. Available from: URL: http://www. Who.int/cancer/countryprofiles/rus_en.pdf?ua=1 7. Whitlock E, Lin J, Liles E, Beil T, Fu R. Screening for Colorectal Cancer: A Targeted, Updated Systematic Review for the U.S. Preventive Services Task Force. Annals of Internal Medicine. 2008;149(9):638. https://doi.org/10.7326/0003-4819-149-9-200811040-00245 8. Sung J. Colorectal cancer screening: Its time for action in Asia. Cancer Detection and Prevention. 2007;31(1):1-2. https://doi.org/10.1016/j.cdp.2007.01.002 9. Hoepffner N, Shastri Y, Hanisch E, et al. Comparative evaluation of a new bedside faecal occult blood test in a prospective multicentre study. Alimentary Pharmacology and Therapeutics. 2006;23(1):145- 154. https://doi.org/10.1111/j.1365-2036.2006.02702.x 10. Minoli, Meucci, Prada et al. Quality Assurance and Colonoscopy. Endoscopy. 1999;31(7):522-527. https://doi.org/10.1055/s-1999-54 11. Rex D. Quality in the technical performance of colonoscopy and the continuous quality improvement process for colonoscopy: recommendations of the U.S. Multi-Society Task Force on Colorectal Cancer. The American Journal of Gastroenterology. 2002;97(6):1296-1308. https://doi.org/10.1016/s0002-9270(02)04168-0 12. Rex DK, Bond JH, Winawer S, et al. Quality in the technical performance of colonoscopy and the continuous quality improvement process for colonoscopy: recommendations of the U.S. Multi-Society Task Force on Colorectal Cancer. The American Journal of Gastroenterology. 2002;97(6):1296-1308. https://doi.org/10.1111/j.1572-0241.2002.05812.x 13. Calderwood Ajacobson B. Comprehensive validation of the Boston Bowel Preparation Scale. Gastrointestinal Endoscopy. 2010;72(4):686-692. https://doi.org/10.1016/j.gie.2010.06.068 14. Lorenzo-Zúñiga V, Moreno-de-Vega V, Boix J. Preparation for colonoscopy: types of scales and cleaning products. Revista Española de Enfermedades Digestivas. 2012;104(8):426-431. https://doi.org/10.4321/s1130-01082012000800006 15. Cohen L. Advances in Bowel Preparation for Colonoscopy. Gastrointestinal Endoscopy Clinics of North America. 2015;25(2):183-197. http://doi.org/10.1016/j.gie.2014.09.048 ESGE О ПОДГОТОВКЕ ТОЛСТОЙ КИШКИ К СКРИНИНГОВОЙ КОЛОНОСКОПИИ 48 ДОКАЗАТЕЛЬНАЯ ГАСТРОЭНТЕРОЛОГИЯ, 3 , 2017 16. Rex DK, Schoenfeld PS, Cohen J, et al. Quality indicators for colonoscopy. Gastrointestinal Endoscopy. 2015;81(1):31-53. https://doi.org/10.1016/j.gie.2014.07.058 17. Belsey J, Epstein O, Heresbach D. Systematic review: oral bowel preparation for colonoscopy. Alimentary Pharmacology & Therapeutics. 2006;25(4):373-384. https://doi.org/10.1111/j.1365-2036.2006.03212.x 18. Kilgore TW., Abdinoor A.A., Szary N.M., et al. Bowel preparation with split-dose polyethylene glycol before colonoscopy: a metaanalysis of randomized controlled trials. Gastrointestinal Endoscopy. 2011;73(6):1240-1245. https://doi.org/10.1016/j.gie.2011.02.007 19. Froehlich F, Wietlisbach V, Gonvers J, Burnand B, Vader J. Impact of colonic cleansing on quality and diagnostic yield of colonoscopy: the European Panel of Appropriateness of Gastrointestinal Endoscopy European multicenter study. Gastrointestinal Endoscopy. 2005;61(3):378-384. https://doi.org/10.1016/s0016-5107(04)02776-2 20. Rex D, Imperiale T, Latinovich D, Bratcher L. Impact of bowel preparation on efficiency and cost of colonoscopy. The American Journal of Gastroenterology. 2002;97(7):1696-1700. https://doi.org/10.1111/j.1572-0241.2002.05827.x 21. Wu K, Rayner C, Chuah S, et al. Impact of Low-Residue Diet on Bowel Preparation for Colonoscopy. Diseases of the Colon & Rectum. 2011;54(1):107-112. https://doi.org/10.1007/dcr.0b013e3181fb1e52 22. Adams W, Meagher A, Lubowski D, King D. Bisacodyl reduces the volume of polyethylene glycol solution required for bowel preparation. Diseases of the Colon & Rectum. 1994;37(3):229-234. https://doi.org/10.1007/bf02048160 23. Aoun E, Abdul-Baki H, Azar C, et al. A randomized single-blind trial of split-dose PEG-electrolyte solution without dietary restriction compared with whole dose PEG-electrolyte solution with dietary restriction for colonoscopy preparation. Gastrointestinal Endoscopy. 2005;62(2):213-218. https://doi.org/10.1016/s0016-5107(05)00371-8 24. Soweid AM, Kobeissy AA, Jamali FR, et al. A randomized singleblind trial of standard diet versus fiber-free diet with polyethylene glycol electrolyte solution for colonoscopy preparation. Endoscopy. 2010;42(08):633-638. https://doi.org/10.1055/s-0029-1244236 25. Park DI, Park SH, Lee SK, et al. Efficacy of prepackaged, low residual test meals with 4L polyethylene glycol versus a clear liquid diet with 4L polyethylene glycol bowel preparation: A randomized trial. Journal of Gastroenterology and Hepatology. 2009;24(6):988- 991. https://doi.org/10.1111/j.1440-1746.2009.05860.x 26. Lever EL, Walter MH, Condon SC, et al. Addition of enemas to oral lavage preparation for colonoscopy is not necessary. Gastrointestinal Endoscopy. 1992;38(3):369-372. 27. Børkje B, Pedersen R, Lund G, et al. Effectiveness and Acceptability of Three Bowel Cleansing Regimens. Scandinavian Journal of Gastroenterology. 1991;26(2):162-166. https://doi.org/10.3109/00365529109025026 28. Sanaka M, Super D, Mullen K, et al. Use of tegaserod along with polyethylene glycol electrolyte solution for colonoscopy bowel preparation: a prospective, randomized, double-blind, placebocontrolled study. Alimentary Pharmacology and Therapeutics. 2006;23(5):669-674. https://doi.org/10.1111/j.1365-2036.2006.02790.x 29. Tongprasert S. Improving quality of colonoscopy by adding simethicone to sodium phosphate bowel preparation. World Journal of Gastroenterology. 2009;15(24):3032. https://doi.org/10.3748/wjg.15.3032 30. Wu L, Cao Y, Liao C, Huang J, Gao F. Systematic review and meta-analysis of randomized controlled trials of Simethicone for gastrointestinal endoscopic visibility. Scandinavian Journal of Gastroenterology. 2010;46(2):227-235. https://doi.org/10.3109/00365521.2010.525714 31. Lazzaroni M, Pertillo M, Desideri S, Porro G. Efficacy and tolerability of polyethylene glycol-electrolyte lavage solution with and without simethicone in the preparation of patients with inflammatory bowel disease for colonoscopy. Alimentary Pharmacology & Therapeutics. 2007;7(6):655-659. https://doi.org/10.1111/j.1365-2036.1993.tb00148.x 32. Tongprasert S. Improving quality of colonoscopy by adding simethicone to sodium phosphate bowel preparation. World Journal of Gastroenterology. 2009;15(24):3032. https://doi.org/10.3748/wjg.15.3032 33. Belsey J, Epstein O, Herrsbach D. Systematic review: oral bowel preparation for colonoscopy. Alimentary Pharmacology & Therapeutics. 2006;25(4):373-384. https://doi.org/10.1111/j.1365-2036.2006.03212.x 34. Hsu Hsu C, Imperiale T. Meta-analysis and cost comparison of polyethylene glycol lavage versus sodium phosphate for colonoscopy preparation. Gastrointestinal Endoscopy. 1998;48(3):276-282. https://doi.org/10.1016/s0016-5107(98)70191-9 35. Juluri R, Eckert G, Imperiale T. Meta-analysis: randomized controlled trials of 4-L polyethylene glycol and sodium phosphate solution as bowel preparation for colonoscopy. Alimentary Pharmacology & Therapeutics. 2010;32(2):171-181. https://doi.org/10.1111/j.1365-2036.2010.04326.x 36. Belsey J, Crosta C, Epstein O, et al. Meta-analysis: the relative efficacy of oral bowel preparations for colonoscopy 1985-2010. Alimentary Pharmacology & Therapeutics. 2011;35(2):222-237. https://doi.org/10.1111/j.1365-2036.2011.04927.x 37. Juluri R, Eckert G, Imperiale T. Polyethylene glycol vs. sodium phosphate for bowel preparation: A treatment arm meta-analysis of randomized controlled trials. BMC Gastroenterology. 2011;11(1). https://doi.org/10.1186/1471-230x-11-38 38. Tan J, Tjandra J. Which is the optimal bowel preparation for colonoscopy — a meta-analysis. Colorectal Disease. 2006;8(4):247- 258. https://doi.org/10.1111/j.1463-1318.2006.00970.x 39. Lawrance I, Willert R, Murray K. Bowel cleansing for colonoscopy: prospective randomized assessment of efficacy and of induced mucosal abnormality with three preparation agents. Endoscopy. 2011;43(05):412-418. https://doi.org/10.1055/s-0030-1256193 40. Worthington J, Thyssen M, Chapman G, et al. A randomized controlled trial of a new 2 litre polyethylene glycol solution versus sodium picosulphate + magnesium citrate solution for bowel cleansing prior to colonoscopy. Current Medical Research and Opinion. 2008;24(2):481-488. https://doi.org/10.1185/030079908x260844 41. Park SS, Sinn DH, Kim YH, et al. Efficacy and Tolerability of Split-Dose Magnesium Citrate: Low-Volume (2 Liters) Polyethylene Glycol vs. Single- or Split-Dose Polyethylene Glycol Bowel Preparation for Morning Colonoscopy. The American Journal of Gastroenterology. 2010;105(6):1319-1326. https://doi.org/10.1038/ajg.2010.79 42. Sharma VK, Chockalingham SK, Ugheoke EA, et al. Prospective, randomized, controlled comparison of the use of polyethylene glycol electrolyte lavage solution in four-liter versus two-liter volumes and pretreatment with either magnesium citrate or bisacodyl for colonoscopy preparation. Gastrointestinal Endoscopy. 1998;47(2):167-171. https://doi.org/10.1016/s0016-5107(98)70351-7 43. Corporaal S, Kleibeuker J, Koornstra J. Low-volume PEG plus ascorbic acid versus high-volume PEG as bowel preparation for colonoscopy. Scandinavian Journal of Gastroenterology. 2010;45(11):1380-1386. https://doi.org/10.3109/00365521003734158 44. Singh H, Turner D, Xue L, et al. Risk of Developing Colorectal Cancer Following a Negative Colonoscopy Examination. JAMA. 2006;295(20):2366. https://doi.org/10.1001/jama.295.20.2366 КЛИНИЧЕСКИЕ РУКОВОДСТВА И РЕКОМЕНДАЦИИ ДОКАЗАТЕЛЬНАЯ ГАСТРОЭНТЕРОЛОГИЯ, 3, 2017 49 45. Baxter N. The Effectiveness of Colonoscopy in Reducing Mortality From Colorectal Cancer. Annals of Internal Medicine. 2009;150(11):819. https://doi.org/10.7326/0003-4819-150-11-200906020-00019 46. Pontone S. Low-volume plus ascorbic acidvshigh-volume plus simethicone bowel preparation before colonoscopy. World Journal of Gastroenterology. 2011;17(42):4689. https://doi.org/10.3748/wjg.v17.i42.4689 47. Corporaal S, Kleibeuker J, Koornstra J. Low-volume PEG plus ascorbic acid versus high-volume PEG as bowel preparation for colonoscopy. Scandinavian Journal of Gastroenterology. 2010;45(11):1380-1386. https://doi.org/10.3109/00365521003734158 48. Abut E, Guveli H, Yasar B, et al. Administration of olive oil followed by a low volume of polyethylene glycol-electrolyte lavage solution improves patient satisfaction with right-side colonic cleansing over administration of the conventional volume of polyethylene glycol-electrolyte lavage solution for colonoscopy preparation. Gastrointestinal Endoscopy. 2009;70(3):515-521. https://doi.org/10.1016/j.gie.2009.01.002 49. Fukudome M, Shimosaki K, Koga K, et al. Synthesis and Ester Cleavage Property of 3A,2B-Anhydro-3B-deoxy-3B-thio-βcyclodextrin. ChemInform. 2007;38(52). https://doi.org/10.1002/chin.200752194 50. Kilgore TW, Abdinoor AA, Szary NM, et al. Bowel preparation with split-dose polyethylene glycol before colonoscopy: a metaanalysis of randomized controlled trials. Gastrointestinal Endoscopy. 2011;73(6):1240-1245. https://doi.org/10.1016/j.gie.2011.02.007 51. Church J. Effectiveness of polyethylene glycol antegrade gut lavage bowel preparation for colonoscopy—timing is the key!. Diseases of the Colon & Rectum. 1998;41(10):1223-1225. https://doi.org/10.1007/bf02258217 52. Varughese S, Kumar A, George A, Castro F. Morning-Only OneGallon Polyethylene Glycol Improves Bowel Cleansing for Afternoon Colonoscopies: A Randomized Endoscopist-Blinded Prospective Study. The American Journal of Gastroenterology. 2010;105(11):2368-2374. https://doi.org/10.1038/ajg.2010.271 53. Matro R, Shnitser A, Spodik M, et al. Efficacy of Morning-Only Compared With Split-Dose Polyethylene Glycol Electrolyte Solution for Afternoon Colonoscopy: A Randomized Controlled Single-Blind Study. The American Journal of Gastroenterology. 2010;105(9):1954-1961. https://doi.org/10.1038/ajg.2010.160 54. Longcroft-Wheaton G, Bhandari P. Same-day Bowel Cleansing Regimen is Superior to a Split-dose Regimen Over 2 Days for Afternoon Colonoscopy. Journal of Clinical Gastroenterology. 2012;46(1):57-61. https://doi.org/10.1097/mcg.0b013e318233a986 55. Eun CS, Han DS, Hyun YS, et al. The Timing of Bowel Preparation Is More Important than the Timing of Colonoscopy in Determining the Quality of Bowel Cleansing. Digestive Diseases and Sciences. 2010;56(2):539-544. https://doi.org/10.1007/s10620-010-1457-1 56. Siddiqui AA, Yang K, Spechler SJ, et al. Duration of the interval between the completion of bowel preparation and the start of colonoscopy predicts bowel-preparation quality. Gastrointestinal Endoscopy. 2009;69(3):700-706. https://doi.org/10.1016/j.gie.2008.09.047 57. Huffman M, Unger R, Thatikonda C, et al. Split-dose bowel preparation for colonoscopy and residual gastric fluid volume: an observational study. Gastrointestinal Endoscopy. 2010;72(3):516- 522. https://doi.org/10.1016/j.gie.2010.03.1125 58. Unger R, Amstutz S, Seo D, Huffman M, Rex D. Willingness to Undergo Split-Dose Bowel Preparation for Colonoscopy and Compliance with Split-Dose Instructions. Digestive Diseases and Sciences. 2010;55(7):2030-2034. https://doi.org/10.1007/s10620-009-1092-x 59. Park J, Sohn C, Hwang S et al. Quality and effect of single dose versus split dose of polyethylene glycol bowel preparation for early-morning colonoscopy. Endoscopy. 2007;39(07):616-619. https://doi.org/10.1055/s-2007-966434 60. Enestvedt B, Fennerty M, Eisen G. Randomised clinical trial: MiraLAX vs. Golytely — a controlled study of efficacy and patient tolerability in bowel preparation for colonoscopy. Alimentary Pharmacology & Therapeutics. 2010;33(1):33-40. https://doi.org/10.1111/j.1365-2036.2010.04493.x 61. Eun CS, Han DS, Hyun YS, et al. The Timing of Bowel Preparation Is More Important than the Timing of Colonoscopy in Determining the Quality of Bowel Cleansing. Digestive Diseases and Sciences. 2010;56(2):539-544. https://doi.org/10.1007/s10620-010-1457-1 62. Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures. Anesthesiology. 2011;114(3):495-511. https://doi.org/10.1097/aln.0b013e3181fcbfd9 63. Haapamäki M, Lindström M, Sandzén B. Low-volume bowel preparation is inferior to standard 4 l polyethylene glycol. Surgical Endoscopy. 2010;25(3):897-901. https://doi.org/10.1007/s00464-010-1293-6 64. Vradelis S. Addition of senna improves quality of colonoscopy preparation with magnesium citrate. World Journal of Gastroenterology. 2009;15(14):1759. https://doi.org/10.3748/wjg.15.1759 65. Ziegenhagen D, Zehnter E, Tacke W, Kruis W. Addition of senna improves colonoscopy preparation with lavage: a prospective randomized trial. Gastrointestinal Endoscopy. 1991;37(5):547-549. https://doi.org/10.1016/s0016-5107(91)70826-2 66. Amato A, Radaelli F, Paggi S, Terruzzi V. Half Doses of PEG-ES and Senna vs. High-Dose Senna for Bowel Cleansing Before Colonoscopy: A Randomized, Investigator-Blinded Trial. The American Journal of Gastroenterology. 2009;105(3):675-681. https://doi.org/10.1038/ajg.2009.598 67. Habr-Gama A, Bringel RW DA, Nahas SC, et al. Bowel preparation for colonoscopy: comparison of mannitol and sodium phosphate. Results of a prospective randomized study. Revista do Hospital das Clínicas. 1999;54(6):187-192. https://doi.org/10.1590/s0041-87811999000600004 68. Rey J, Beilenhoff U, Neumann C, Dumonceau J. European Society of Gastrointestinal Endoscopy (ESGE) guideline: the use of electrosurgical units. Endoscopy. 2010;42(09):764-772. https://doi.org/10.1055/s-0030-1255594 69. Brunelli S. Association Between Oral Sodium Phosphate Bowel Preparations and Kidney Injury: A Systematic Review and Metaanalysis. American Journal of Kidney Diseases. 2009;53(3):448- 456. https://doi.org/10.1053/j.ajkd.2008.09.022 70. Pálmadóttir V, Gudmundsson H, Hardarson S, et al. Incidence and Outcome of Acute Phosphate Nephropathy in Iceland. PloS ONE. 2010;5(10):e13484. https://doi.org/10.1371/journal.pone.0013484 71. Hsu C, Imperiale T. Meta-analysis and cost comparison of polyethylene glycol lavage versus sodium phosphate for colonoscopy preparation. Gastrointestinal Endoscopy. 1998;48(3):276-282. https://doi.org/10.1016/s0016-5107(98)70191-9 72. Juluri R, Eckert G, Imperiale T. Polyethylene glycol vs. sodium phosphate for bowel preparation: A treatment arm meta-analysis of randomized controlled trials. BMC Gastroenterology. 2011;11(1). https://doi.org/10.1186/1471-230x-11-38 73. Hookey L, Vanner S. Recognizing the Clinical Contraindications to the Use of Oral Sodium Phosphate for Colon Cleansing: A Case Study. Canadian Journal of Gastroenterology. 2004;18(7):455-458. https://doi.org/10.1155/2004/787515 ESGE О ПОДГОТОВКЕ ТОЛСТОЙ КИШКИ К СКРИНИНГОВОЙ КОЛОНОСКОПИИ 50 ДОКАЗАТЕЛЬНАЯ ГАСТРОЭНТЕРОЛОГИЯ, 3 , 2017 74. Wexner SD, Force T, Beck DE, et al. A consensus document on bowel preparation before colonoscopy: Prepared by a Task Force From The American Society of Colon and Rectal Surgeons (ASCRS), the American Society for Gastrointestinal Endoscopy (ASGE), and the Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). Gastrointestinal Endoscopy. 2006;63(7):894-909. https://doi.org/10.1016/j.gie.2006.03.918 75. Marshall J, Pineda J, Barthel J, King P. Prospective, randomized trial comparing sodium phosphate solution with polyethylene glycol—electrolyte lavage for colonoscopy preparation. Gastrointestinal Endoscopy. 1993;39(5):631-634. https://doi.org/10.1016/s0016-5107(93)70213-8 76. Zhang Q, Rothenbacher D. Prevalence of chronic kidney disease in population-based studies: Systematic review. BMC Public Health. 2008;8(1). https://doi.org/10.1186/1471-2458-8-117 77. Russmann S, Lamerato L, Marfatia A, et al. Risk of Impaired Renal Function After Colonoscopy: A Cohort Study in Patients Receiving Either Oral Sodium Phosphate or Polyethylene Glycol. The American Journal of Gastroenterology. 2007;102(12):2655- 2663. https://doi.org/10.1111/j.1572-0241.2007.01610.x 78. Tae JW, Lee JC, Hong SJ, et al. Impact of patient education with cartoon visual aids on the quality of bowel preparation for colonoscopy. Gastrointestinal Endoscopy. 2012;76(4):804-811. https://doi.org/10.1016/j.gie.2012.05.026 79. Spiegel BM, Talley J, Shekelle P, et al. Development and Validation of a Novel Patient Educational Booklet to Enhance Colonoscopy Preparation. The American Journal of Gastroenterology. 2011;106(5):875-883. https://doi.org/10.1038/ajg.2011.75 80. Borg B, Gupta N, Zuckerman G, et al. Impact of Obesity on Bowel Preparation for Colonoscopy. Clinical Gastroenterology and Hepatology. 2009;7(6):670-675. https://doi.org/10.1016/j.cgh.2009.02.014 81. Ben-Horin S, Bar-Meir S, Avidan B. The outcome of a second preparation for colonoscopy after preparation failure in the first procedure. Gastrointestinal Endoscopy. 2009;69(3):626-630. https://doi.org/10.1016/j.gie.2008.08.027 82. Ibáñez M, Parra-Blanco A, Zaballa P, et al. Usefulness of an Intensive Bowel Cleansing Strategy for Repeat Colonoscopy After Preparation Failure. Diseases of the Colon & Rectum. 2011;54(12):1578-1584. https://doi.org/10.1097/dcr.0b013e31823434c8 83. Lieberman D, Nadel M, Smith RA, et al. Standardized colonoscopy reporting and data system: report of the Quality Assurance Task Group of the National Colorectal Cancer Roundtable. Gastrointestinal Endoscopy. 2007;65(6):757-766. https://doi.org/10.1016/j.gie.2006.12.055 84. de Jonge V, Sint Nicolaas J, Cahen DL, et al. Quality evaluation of colonoscopy reporting and colonoscopy performance in daily clinical practice. Gastrointestinal Endoscopy. 2012;75(1):98-106. https://doi.org/10.1016/j.gie.2011.06.032 85. Rigaux J, Juriens I, Devière J. A novel system for the improvement of colonic cleansing during colonoscopy. Endoscopy. 2012;44(07):703-706. https://doi.org/10.1055/s-0032-1309890 86. Cappell M, Colon V, Sidhom O. A study at 10 medical centers of the safety and efficacy of 48 flexible sigmoidoscopies and 8 colonoscopies during pregnancy with follow-up of fetal outcome and with comparison to control groups. Digestive Diseases and Sciences. 1996;41(12):2353-2361. https://doi.org/10.1007/bf02100127 87. Vinod J. Choice of laxatives and colonoscopic preparation in pregnant patients from the viewpoint of obstetricians andgastroenterologists. World Journal of Gastroenterology. 2007;13(48):6549. https://doi.org/10.3748/wjg.13.6549 88. Atkinson R, Save V, Hunter J. Colonic Ulceration After Sodium Phosphate Bowel Preparation. The American Journal of Gastroenterology. 2005;100(11):2603-2605. https://doi.org/10.1111/j.1572-0241.2005.00305_11.x 89. Coskun A, Uzunkoy A, Duzgun S, et al. Experimental sodium phosphate and polyethylene glycol induce colonic tissue damage and oxidative stress. British Journal of Surgery. 2001;88(1):85-89. https://doi.org/10.1046/j.1365-2168.2001.01608.x 90. Erdogan B, Isiksoy S, Dundar E, et al. The effects of sodium phosphate and polyethylene glycol-electrolyte bowel preparation solutions on 2,4,6-trinitrobenzenesulfonic acid-induced colitis in the rat. Experimental and Toxicologic Pathology. 2003;55(2-3):213- 220. https://doi.org/10.1078/0940-2993-00318 91. Colacchio T, Forde K, Patsos T, Nunez D. Impact of modern diagnostic methods on the management of active rectal bleeding. The American Journal of Surgery. 1982;143(5):607-610. https://doi.org/10.1016/0002-9610(82)90175-1 92. Bretthauer M, Aabakken L, Dekker E, et al. Reporting systems in gastrointestinal endoscopy: Requirements and standards facilitating quality improvement: European Society of Gastrointestinal Endoscopy position statement. United European Gastroenterology Journal. 2016;4(2):172-176. https://doi.org/10.1177/2050640616629079 93. Комарова Л.Е. Колоректальный рак: современное состояние скрининговых программ. HI+MED. 2016;3(40) Д. Ссылка активна на 02.09.2017. [Komarova LE. Kolorektal’nyi rak: sovremennoe sostoyanie skriningovykh programm. HI+MED. 2016;3(40) D. Ssylka aktivna na 02.09.2017. (In Russ.)]. http://www.himedtech.ru/articles/?SECTION_ID=128&ELEMENT_ ID=1743












.jpg)



.png)


.jpg)














Комментарии