- Компании
- Takeda. О компании, буклеты, каталоги, контакты
- Olympus. О компании, буклеты, каталоги, контакты
- Boston Scientific. О компании, буклеты, каталоги, контакты
- Pentax. О компании, буклеты, каталоги, контакты
- Fujifilm & R-Farm. О компании, буклеты, каталоги, контакты
- Erbe. О компании, буклеты, каталоги, контакты
- Еще каталоги
- Мероприятия
- Информация
- Обучение
- Дайджест
- QuaCol
- Разделы
- Пациентy
QR-код этой страницы
Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Статьи: Новый эндоскопический алгоритм диагностики раннего рака желудка: протокол «4D»
| Авторы: | Кашин С.В. 1 Куваев Р.О. 2 Крайнова Е.А. 3 Никонов Е.Л. 4 2022г. |
| Об авторах: |
1. ГБУЗ ЯО «Областная клиническая онкологическая больница» 2. ГБУЗ ЯО «Областная клиническая онкологическая больница»; ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России 3. ГБУЗ Ярославской области «Ярославская областная клиническая онкологическая больница» 4. ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России |
Полный текст статьи:
Kashin SV, Kuvaev RO, Krainova EA, Nikonov EL. New diagnostic algorithm for early detection of gastric cancer: 4D protocol. Russian Journal of Evidence-Based Gastroenterology. 2022;11(3):29‑36. (In Russ.)
https://doi.org/10.17116/dokgastro20221103129
Несмотря на расширение диагностических возможностей, улучшающуюся оснащенность медицинских учреждений высокотехнологичным диагностическим оборудованием, развитие и внедрение новых диагностических методик, доли активно выявленных больных и больных, рак желудка у которых обнаружен на ранней стадии, остаются достаточно низкими. В России рак желудка более чем в 70% случаев диагностируется на III—IV стадии заболевания, что предопределяет неудовлетворительные результаты лечения и плохой прогноз, и лишь около 10% случаев рака желудка выявляется при эндоскопическом исследовании на ранней стадии, даже при современных возможностях эндоскопии [1]. Рак желудка в мире занимает четвертое место в структуре заболеваемости и второе — по смертности от онкологических заболеваний и является одной из самых важных социально-экономических проблем мирового и отечественного здравоохранения. Ежегодно регистрируется более 1 млн (5,6% в структуре онкологической заболеваемости) новых случаев и 768 тыс. (7,7% в структуре онкологической заболеваемости) смертей [2]. Это наиболее агрессивная по течению и прогнозу злокачественная эпителиальная опухоль человека. Различия между уровнями заболеваемости и смертности незначительны, что согласуется с низкой продолжительностью жизни таких больных.
От того, насколько квалифицированно проведено эндоскопическое исследование, направленное не только на обнаружение мельчайших структурных изменений слизистой оболочки, но и на адекватную их интерпретацию, насколько прецизионно выполнена прицельная биопсия, зависит успешность диагностики и своевременность лечения предопухолевых заболеваний и раннего рака желудка и в итоге судьба пациента [3—8]. Нами разработан алгоритм, позволяющий повысить эффективность эндоскопического исследования верхних отделов желудочно-кишечного тракта, улучшить диагностику предраковых изменений и ранних форм рака желудка. Этот алгоритм положен в основу современной модели организации эндоскопического исследования и включает в себя последовательные этапы выполнения эндоскопического исследования желудка, детальное описание всех диагностических манипуляций, а также условия и техническое обеспечение их проведения.
Алгоритм диагностики состоит из четырех основных этапов («4D»):
1. Detection — обнаружение.
2. Delineation — определение границ.
3. Differentiation — дифференциальный диагноз.
4. Depth of invasion — прогнозирование глубины инвазии.
Detection — обнаружение. Базовой эндоскопической методикой для выявления образований желудка является стандартная методика визуализации в белом свете. В Японии и странах восточной Азии она часто дополняется хромоскопией с использованием раствора индигокармина, однако до настоящего времени не проведены рандомизированные контролируемые исследования, демонстрирующие преимущество хромоскопии в выявлении раннего рака желудка [9].
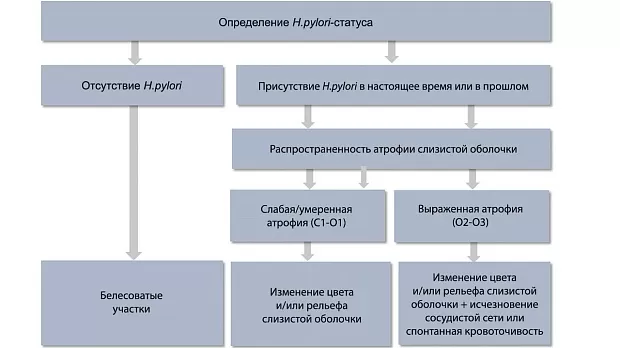
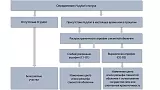
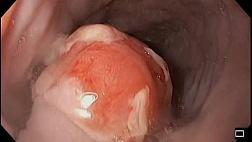
Ключевыми признаками раннего рака желудка являются локальное изменение цвета (красный или белый участок) и/или рельефа (углубленный или приподнятый участок) по сравнению с фоновой слизистой оболочкой, дополнительными признаками — локальное исчезновение сосудистой сети или спонтанная кровоточивость [10]. Тактика поиска признаков раннего рака желудка базируется на выявлении особенностей фоновой слизистой оболочки [11] (рис. 1).
Рис. 1. Тактика выявления эндоскопических признаков раннего рака желудка в зависимости от колонизации Helicobacter pylori и фонового состояния слизистой оболочки.
Delineation — определение границ. Современные методики контрастирования (хромоскопия с индигокармином, узкоспектральная эндоскопия) в большинстве случаев позволяют улучшить качество визуализации границ раннего рака желудка и соответственно размера образования [12, 13]. В связи с этим при неэффективности определения границ образования в белом свете рекомендовано дополнительное использование хромоскопии индигокармином, использование узкоспектрального режима визуализации с функцией увеличения. Однако в некоторых случаях (как правило, в случае внутрислизистого латерального роста опухоли при низкодифференцированном типе рака) дополнительные эндоскопические методики не позволяют определить точные границы образования, поэтому для адекватной диагностики патологического процесса и его границ требуется выполнение биопсии из окружающей слизистой оболочки по окружности кнаружи (как минимум на 5 мм) от видимого края образования [14, 15].
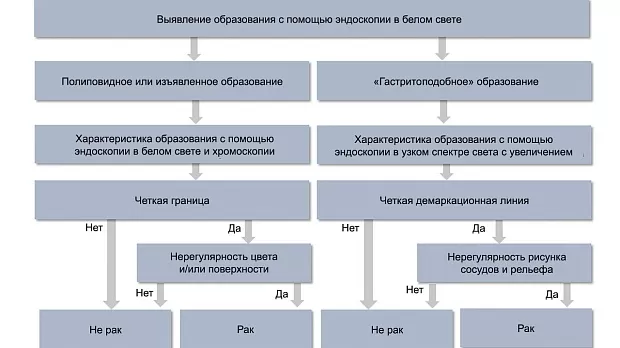
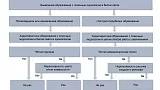
Differentiation — дифференциальная диагностика. При выявлении полиповидных или изъязвленных образований дифференциальную диагностику можно провести в стандартном режиме визуализации в соответствии с системой GUP [16] (рис. 2). Согласно этой системе, для диагностики раннего рака желудка требуется обязательное наличие двух критериев:
— четкая линия границы;
— нерегулярный цвет и/или рельеф.
Рис. 2. Алгоритм эндоскопической дифференциальной диагностики эпителиальных образований желудка.
Дифференциальная диагностика «гастритоподобных» образований представляет собой сложную задачу, для этой цели широко и эффективно используется узкоспектральный осмотр в сочетании с оптическим увеличением изображения. В целом для доброкачественных образований независимо от их гистологического строения характерен правильный (регулярный) микрососудистый рисунок и правильный (регулярный) рисунок микроструктуры поверхности эпителия. Важнейшим признаком раннего рака желудка является наличие неправильного (нерегулярного) микрососудистого рисунка и/или неправильного (нерегулярного) или полностью разрушенного рисунка поверхности эпителия с наличием демаркационной линии образования. Эти универсальные признаки стали основой для так называемой VS (vessel plus surface) классификации [17—19], предложенной K. Yao, которая применяется с целью дифференциальной диагностики доброкачественных и злокачественных образований желудка. С практической точки зрения при использовании узкоспектральной увеличительной эндоскопии используется алгоритм MESDA-G (Magnifying endoscopy simple diagnostic algorithm for gastric cancer) [20] (см. рис. 2), в соответствии с которым для диагностики раннего рака желудка/дисплазии высокой степени требуется обязательное наличие двух критериев:
— демаркационная линия;
— нерегулярный рисунок микрососудов и микрорельефа.
«Нерегулярность» цвета или рельефа (при макроскопическом эндоскопическом осмотре), а также рисунка микрососудов и микрорельефа (при увеличительном осмотре) может быть визуально определена путем сравнения четырех квадрантов, получаемых при разделении изображения с помощью двух линий, перекрещивающихся в центре участка (принцип «magic cross» профессора K. Yao).
В случае недифференцированного типа раннего рака желудка возможности современной эндоскопии, даже при применении современных диагностических методик, ограничены. Это связано с морфологическими особенностями недифференцированного типа рака, поскольку распространение опухоли зачастую идет в средней части собственно слизистой оболочки под слоем относительно неизмененного эпителия [21]. По этой причине эндоскопическая диагностика раннего рака данного гистологического типа базируется на осмотре в стандартном режиме визуализации.
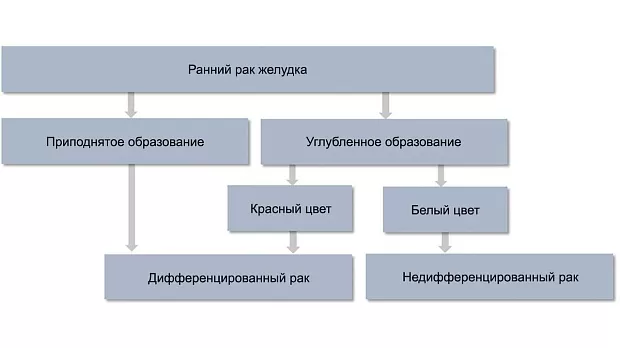
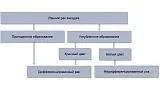
Другой целью этапа дифференциальной диагностики является прогнозирование гистологического типа раннего рака. При эндоскопическом осмотре в белом свете ранний рак дифференцированного типа определяется как приподнятое образование (любого цвета) либо углубленное образование красного цвета, недифференцированный ранний рак желудка — как углубленный белесоватый участок [22, 23] (рис. 3).
Рис. 3. Алгоритм дифференциальной диагностики гистологических типов раннего рака желудка с помощью эндоскопии в белом свете.
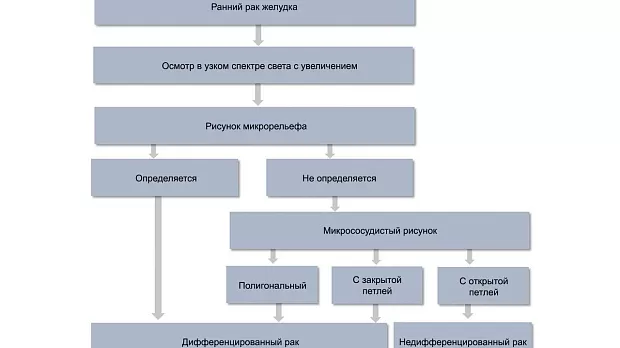
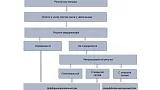
При осмотре в узком спектре света с увеличением эндоскопическая картина также отличается [24] (рис. 4). Для дифференцированного типа раннего рака характерно сохранение рисунка микрорельефа, а при его полном разрушении — полигональная сосудистая сеть («тонкая сеть» — fine network pattern) или наличие нерегулярных микрососудов с «закрытой» петлей (микрососуды, соединяющиеся между собой). Низкодифференцированный ранний рак характеризуется полностью разрушенным рисунком микрорельефа и нерегулярными микрососудами с открытой петлей («штопорообразные» сосуды — corkscrew pattern) [25].
Рис. 4. Алгоритм дифференциальной диагностики гистологических типов раннего рака желудка с помощью эндоскопии в узком спектре света с увеличением.
Depth of invasion — прогнозирование глубины инвазии. Определение характерных признаков инвазивного роста опухоли и возможности эндоскопического удаления раннего рака желудка возможно при проведении эндоскопии в стандартном режиме визуализации (см. таблицу). В отдельных случаях для проведения T-стадирования с целью оценки резектабельности раннего рака желудка возможно проведение эндосонографии, однако рутинное использование эндосонографии в каждом случае перед проведением эндоскопической резекции не рекомендуется, поскольку это не меняет тактику лечения пациента [26, 27]. Для внутрислизистого рака характерны типы 0—I и 0—II (0—IIa, 0—IIb, 0—IIc) по Парижской классификации, ровная поверхность образования, незначительное краевое возвышение, ровное сглаживание складок слизистой оболочки. К признакам инвазивного роста опухоли в подслизистый слой относятся тип 0—III по Парижской классификации, нерегулярная/нодулярная поверхность образования, выраженное краевое возвышение, резкий обрыв или слияние конвергирующих складок. Ярким эндоскопическим признаком инвазии в глубокий отдел подслизистого слоя (SM2 500 мкм и более) является признак «отсутствия растяжения» («non-extension sign») [28] в зоне раннего рака: при максимальной инсуффляции воздуха/CO2 область инвазивного роста не растягивается и формирует трапециевидную протрузию, а конвергирующие складки фоновой слизистой оболочки возвышаются над зоной инвазии.
Эндоскопические признаки определения глубины инвазии раннего рака желудка
|
Параметр |
Характеристика | |
|
Внутрислизистый рак, минимальная инвазия в подслизистый слой M—SM1 (возможно выполнение эндоскопического удаления) |
Глубокая инвазия в подслизистый слой — SM2 и более (выполнение эндоскопического удаления не показано) | |
|
Парижская классификация |
0—I, 0—IIa, 0—IIb, 0—IIc |
0—III |
|
Поверхность |
Гладкая |
Нерегулярная/нодулярная |
|
Края |
Незначительное краевое возвышение |
Выраженное краевое возвышение |
|
Складки фоновой слизистой оболочки |
Ровное сглаживание складок слизистой оболочки |
Резкий обрыв или слияние конвергирующих складок |
|
Признак «отсутствия растяжения» |
Отрицательный |
Положительный |
Пример выполнения алгоритма «4D» и гистологической верификации диагноза показан на рис. 5.
Рис. 5. Диагностика раннего рака желудка в соответствии с протоколом «4D».
Detection — обнаружение: локальный углубленный участок красного цвета верхней трети тела желудка по малой кривизне; Delineation — определение границ: граница четкая, демаркационная линия прослеживается, размер патологического образования около 8 мм; Differentiation — дифференциальный диагноз: рисунок микрорельефа нерегулярный и местами разрушенный, рисунок микрососуов нерегулярный, в виде полигональной сети (характерно для раннего рака желудка дифференцированного типа); Depth of invasion — прогнозирование глубины инвазии: тип 0—IIc по Парижской классификации, поверхность ровная, края сглажены, признак «отсутствия растяжения» не определяется (характерно для внутрислизистого рака). а — эндоскопическая картина в белом свете; б — эндоскопическая картина в узком спектре света с увеличением; в — гистологическое исследование пострезекционного препарата после выполнения эндоскопической подслизистой диссекции (гематоксилин, эозин): тубулярная высокодифференцированная аденокарцинома, размер 4 мм (Tub, G1, 4 mm, M3, HM0, VM0, R0, l0, v0).
Заключение
Современная гастроскопия, проводимая с целью диагностики предраковых изменений и ранних форм рака, предполагает использование всех современных технологий, позволяющих выявлять патологические образования даже самых небольших размеров: увеличительной эндоскопии, хромоскопии и узкоспектральной эндоскопии. Наиболее эффективное и рациональное сочетание этих диагностических методик с целью визуализации очаговых структурных изменений слизистой оболочки желудка возможно при использовании современного диагностического алгоритма в повседневной клинической практике. Совершенствование последнего путем включения в него новых диагностических технологий, позволяющих провести эффективную дифференциальную диагностику неопластических изменений, позволит повысить эффективность диагностики предраковых изменений слизистой оболочки и раннего рака желудка у пациентов, подлежащих скринингу.
Авторы заявляют об отсутствии конфликта интересов.
.
Рекомендуемые статьи
При эндоскопическом исследовании в случае бронхоэктазов в стадии ремиссии выявляется
частично диффузный бронхит I степени воспаления
Активируйте PUSH уведомления в браузер
Отключите PUSH уведомления в браузер
Содержание
Интернет магазин
Популярное
- О нас
- Правовые вопросы
- Политика
обработки персональных
данных EndoExpert.ru - Связаться с нами
- Стать партнером
© 2016-2022 EndoExpert.ru

Вы находитесь в разделе предназначенном только для специалистов (раздел для пациентов по ссылке). Пожалуйста, внимательно прочитайте полные условия использования и подтвердите, что Вы являетесь медицинским или фармацевтическим работником или студентом медицинского образовательного учреждения и подтверждаете своё понимание и согласие с тем, что применение рецептурных препаратов, обращение за той или иной медицинской услугой, равно как и ее выполнение, использование медицинских изделий, выбор метода профилактики, диагностики, лечения, медицинской реабилитации, равно как и их применение, возможны только после предварительной консультации со специалистом. Мы используем файлы cookie, чтобы предложить Вам лучший опыт взаимодействия. Файлы cookie позволяют адаптировать веб-сайты к вашим интересам и предпочтениям.
Я прочитал и настоящим принимаю вышеизложенное, хочу продолжить ознакомление с размещенной на данном сайте информацией для специалистов.



.jpg)




.png)


















Комментарии